 | |||
|---|---|---|---|
| El metabolismo
cerebral: glucógeno, lactato y cuerpos cetónicos |
| ||
| Laboratorio de Neurobiología del Desarrollo Instituto de Investigaciones Bioquímicas de Bahía Blanca | Lic. María Fernanda Insua mfinsua@criba.edu.ar (Argentina) |
| |
| http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 9 - N° 62 - Julio de 2003 |
| ||
1 / 1
Por mucho tiempo se ha creído que la glucosa es el sustrato energético obligatorio para el cerebro, que se oxida completamente a CO2 y H2O, y que el metabolismo energético del cerebro a menudo se considera que refleja predominantemente o casi exclusivamente el metabolismo energético neuronal. Sin embargo, en la actualidad está claro que otro tipo de células, las que conforman la denominada neuroglia y las células que recubren los vasos sanguíneos (células endoteliales), no sólo consumen energía, sino que además pueden jugar un rol activo en el flujo de los sustratos energéticos hacia las neuronas.
Los astrocitos son células con aspecto estrellado que forman parte de la neuroglia, y entre otras importantes funciones, mantienen la homeostasis del K+ extracelular, y aseguran la recaptación de los neurotransmisores para que el impulso nervioso cese.
Observaciones in vitro indican que la utilización de glucosa ocurre cerca de los sitios sinápticos (donde termina el axón y el pie neuronal), no en el cuerpo de la neurona, y los astrocitos son las células más probables donde ocurre la captación de glucosa.
Estudios in vitro indican que el lactato es cuantitativamente el principal intermediario metabólico liberado por los astrocitos, a una velocidad de 15-30 nmol/mg de prot x min. Esta velocidad se correlaciona bien con la velocidad de captura de glucosa por la materia gris o por astrocitos en cultivo, la cual es de entre 5 y 15 nmol/mg prot x min. No liberan glucosa en cultivo, aún cuando la glucosa está ausente del medio.
En el cerebro el glucógeno se almacena principalmente en los astrocitos y aunque los niveles son bajos, comparados con el hígado y el músculo, la tasa de recambio (turnover) es muy rápida, y sus niveles están estrechamente acoplados a la actividad sináptica. Ej: durante la anestesia, los niveles de glucógeno aumentan abruptamente y los astrocitos que se hallan en áreas donde la actividad neuronal está disminuida o ausente, como consecuencia de alguna injuria, también contienen altas cantidades de glucógeno. Esto ocurre porque disminuye la actividad neuronal, entonces el glucógeno permanece almacenado, no se utiliza.
El péptido intestinal vasoactivo (VIP) y la norepinefrina (NE) promueven la glucogenólisis en los astrocitos, en una forma dependiente del tiempo y de la concentración. Parece que el glucógeno astrocitario representa un "buffer metabólico", bajo el control dinámico de la actividad neuronal.
Neuronas, glucógeno y lactatoEn el cerebro coexisten muchos tipos de células que permiten un funcionamiento adecuado de un tejido tan complejo, pero básicamente podemos decir que un 20% del total de células son neuronas y el 80% restante corresponde a células denominadas gliales, de las que existen varios tipos diferentes.
A pesar de que el cerebro humano constituye el 2% del peso corporal, los procesos que consumen energía para asegurar su funcionamiento, dan cuenta del 25% del total de la glucosa utilizada en el cuerpo y casi del 20% del consumo de O2 de todo el organismo, es decir cerca de 160Umol/100 g de peso de tejido cerebral. Con un flujo global de 57 ml/100 g/min, el cerebro extrae aproximadamente el 50% del oxígeno y 10% de glucosa de la sangre arterial. Por lo tanto, la utilización de glucosa por parte del cerebro, estimada por mediciones de la diferencia entre sangre arterial y venosa, es de 31 mmol/100 g/min. Como el consumo de oxígeno es prácticamente igual a la producción de CO2, el cociente respiratorio (RQ) es cercano a 1, indicando que los carbohidratos son los sustratos utilizados para el metabolismo oxidativo. Dada una estequiometría teórica de 6 mmol de oxígeno consumidos por cada mmol de glucosa, la utilización de glucosa por parte del cerebro sería en teoría de 26.6 mmol/100g/min. Sin embargo, como se indicó anteriormente, la utilización de glucosa medida es de 31 mmol/100 g/min, lo que indica que un exceso de 4.4 mmol/100 g/min de glucosa sigue otros destinos metabólicos.
El cerebro puede tanto oxidar carbohidratos (CHO) en forma de glucosa o lípidos en la forma de cuerpos cetónicos.
En condiciones basales, la captura y la metabolización de la glucosa ocurre en todos los tipos celulares presentes en el cerebro, y su captación está mediada por transportadores específicos distribuidos de manera diferencial según el tipo de célula. Aunque básicamente el combustible por excelencia en el cerebro es la glucosa, ésta puede producir intermediarios metabólicos, como el lactato y el piruvato, los cuales no necesariamente entran al ciclo de los ácidos tricarboxílicos, sino que también pueden ser liberados y removidos por la circulación.
De hecho algunos estudios in vitro indican que el lactato y el piruvato son sustratos adecuados para ser utilizados por el tejidos cerebral; el lactato es cuantitativamente el principal intermediario metabólico liberado por los astrocitos en cultivo, a una velocidad de 15-30 nmol/mg prot/min. Otros intermediarios liberados cuantitativamente menos relevantes son el piruvato (10 veces menos que el lactato), el a-cetoglutarato, el citrato y el malato.
Se ha demostrado también que las neuronas son capaces de tomar lactato liberado por los astrocitos, y que la producción de lactato aumenta al estimular a los astrocitos en cultivo, con el neurotransmisor glutamato, el principal neurotransmisor excitatorio del sistema nervioso, que estimula la glucólisis en los astrocitos. Finalmente, existe evidencia acerca de que las neuronas en cultivo, poseen un sistema de transportadores específicos y saturables para lactato.
Por lo tanto se puede plantear un modelo metabólico en el cual existe una compartimentalización metabólica: la glucosa tomada de los capilares sanguíneos por los astrocitos se metaboliza glucolíticamente en los mismos, generando lactato, el cual es liberado al espacio extracelular para ser utilizado por las neuronas. (Fig 1)
Estudios realizados en la retina de abejas y de cobayos, han corroborado la existencia de estos flujos metabólicos entre un tipo de células gliales propias de la retina (células de Müller), y las neuronas fotorreceptoras. Además se ha observado la liberación de productos de la glucólisis por parte de estas células gliales. En particular en la retina de abeja, liberan alanina, producida por transaminación del piruvato, la cual es capturada por las neuronas fotorreceptoras, y luego de una nueva reconversión a piruvato, puede entrar al ciclo de los ácidos tricarboxílicos para producir ATP por fosforilación oxidativa.
A pesar de que el lactato plasmático no puede sustituir completamente a la glucosa como sustrato metabólico para el cerebro por su limitada permeabilidad para atravesar la barrera hemato-encefálica, el lactato formado en el cerebro (a través de la glucólisis en astrocitos activada por glutamato), puede cubrir las necesidades energéticas de las neuronas.
El lactato, luego de la conversión en piruvato por la LDH (lactato deshidrogenasa), puede proveer 18 ATP a través de la fosforilación oxidativa.
Fig 1: compartimentalización del metabolismo cerebral: astrocito, 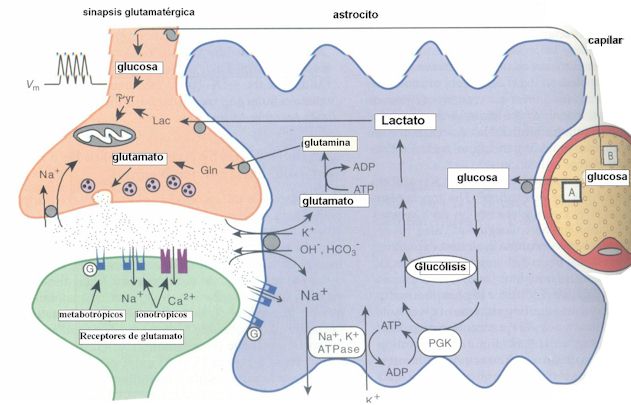
neurona y capilar sanguíneo (modificado de Magistretti, 1999)El glucógeno se almacena en los astrocitos
El glucógeno es la reserva única y más importante de energía en el cerebro, y se localiza en los astrocitos.
En comparación con el contenido en el hígado y el músculo, la cantidad de glucógeno en el cerebro es muy pequeña (100 y 10 veces inferior respectivamente). Por lo tanto difícilmente el cerebro pueda ser considerado un órgano de reserva de glucógeno, y entonces debe ser visto como proveedor de un buffer metabólico durante la actividad fisiológica.
El metabolismo del glucógeno está acoplado a la actividad neuronal
El recambio (turnover) de glucógeno en el cerebro es extremadamente rápido, y los niveles de glucógeno son finamente coordinados por la actividad sináptica. Por ejemplo, durante una anestesia general, una condición en la cual la actividad neuronal sináptica se encuentra marcadamente atenuada, los niveles de glucógeno se elevan abruptamente. Interesantemente, sin embargo, el contenido de glucógeno de astrocitos en cultivo no se incrementa por anestesia general; esta observación indica que la acción general de los anestésicos sobre el glucógeno de los astrocitos in vivo es debida a la inhibición de la actividad neuronal, poniendo de relieve la existencia de un estrecho acoplamiento entre la actividad sináptica y el glucógeno astrocitario.
Entonces cuando hay daño cerebral por heridas o injurias, la actividad sináptica disminuye o se encuentra ausente, por lo tanto los astrocitos de esa zona contienen altas cantidades de glucógeno.
Por ejemplo, en la enfermedad de Alzheimer (EA), investigaciones realizadas en la década de los años ochenta, han demostrado que el turnover de glucosa se halla dramáticamente disminuido en esos pacientes.
Esta reducción del metabolismo de la glucosa cerebral es progresivo con la edad, se acentúa al inicio de los síntomas de la enfermedad y se agrava en fases avanzadas del proceso neurodegenerativo. La reducción oscila entre un 19% en casos leves y un 40% en casos severos, reflejando un paralelismo entre el grado de deterioro cognitivo y el déficit metabólico de glucosa. Esta alteración metabólica contribuye de forma considerable al fracaso en la síntesis de diversos neurotransmisores, como acetilcolina, serotonina y noradrenalina. De hecho la síntesis de acetilcolina se afecta de modo particular debido a que requiere acetil-CoA, un factor derivado enteramente de la glucólisis cerebral. Como los niveles de glucosa periférica en la EA tienden a ser normales, se supone la existencia de un deterioro parcial del transporte de glucosa a nivel de la barrera hematoencefálica (BHE). Se han planteado varias razones por las cuales puede producirse un fracaso del metabolismo de la glucosa en esta enfermedad: 1- las alteraciones de los capilares sanguíneos pueden contribuir a disfunciones hemodinámicas que remueven la glucosa de la capa libre de células o evitan la entrada de glucosa en esta lámina fluida esencial para su ulterior transporte al tejido cerebral; 2- una alteración en el transportador de glucosa GLUT-1 en las células endoteliales de la barrera hematoencefálica y un deterioro parcial del transportador de glucosa GLUT-3, que introduce la glucosa en las neuronas, podrían contribuir definitivamente a disminuir el metabolismo glucídico cerebral; 3- una reducción de la enzima hexokinasa, que cataliza la reacción de fosforilación de la glucosa a glucosa-6-fosfato durante la glucólisis, ha sido detectada en la EA. Después de la conversión a glucosa-6-fosfato, la glucólisis continúa produciendo piruvato, que entra en las mitocondrias y es convertido en acetil-CoA por el complejo enzimático de la piruvato deshidrogenasa, generando por último compuestos de fosfato ricos en energía que producen ATP. Sin embargo, la producción de acetilcolina y acetil-CoA pueden verse afectados porque la actividad piruvato deshidrogenasa se halla reducida en la EA; 4- una amenaza adicional al metabolismo de la glucosa cerebral en la EA proviene del daño presente en el ADN mitocondrial que contribuye a la formación de radicales libres, con la consecuente pérdida energética derivada de la fosforilación oxidativa; 5- un obstáculo final para el metabolismo de la glucosa cerebral en la EA podría proceder de la desensibilización de los receptores neuronales de insulina, con una reducción en la actividad de enzimas críticas en la glucólisis cerebral y la consiguiente disminución de energía producida. Todas las evidencias parecen sugerir que en la EA se produce un deterioro metabólico cerebral por disminución del metabolismo energético.
Algunos neurotransmisores regulan el metabolismo del glucógeno en los astrocitos
Los niveles de glucógeno en los astrocitos se encuentran estrechamente regulados por varios neurotransmisores.
Algunos neurotransmisores monoamina como la noradrenalina, serotonina e histamina, son glucogenolíticos en el cerebro, además de ciertos péptidos, como el péptido intestinal vasoactivo (VIP), la adenosina y el ATP.
Los efectos de todos estos neurotransmisores están mediados por receptores específicos acoplados a vías de señalización intracelular.
No está claro si las unidades glucosil movilizadas a través de la glucogenólisis son utilizadas por los astrocitos para satisfacer sus propias demandas o si son metabolizadas a otra sustancia como lactato el cual es luego liberado para ser usado por las neuronas. Al parecer, la glucosa no es liberada por los astrocitos luego de la glucogenólisis, y evidencia in vitro sugiere que el lactato podría ser el intermediario metabólico producido a través de la glucogenólisis y exportado desde los astrocitos hacia las neuronas.
Observaciones experimentales muestran que señales neuronales (por ejemplo ciertos neurotransmisores), pueden ejercer sobre los astrocitos efectos metabólicos mediados por receptores, de una manera similar a como lo hacen las hormonas periféricas con sus células target o blanco. Sin embargo, la acción de este tipo de neurotransmisores está especificado temporalmente y restringida espacialmente a áreas activadas.
Estos estudios indican que la activación fisiológica de circuitos neuronales específicos, resultan en la movilización de reservas de glucógeno glial.
En conclusión, los astrocitos cumplen un rol crítico en la utilización de la glucosa acoplada a la transmisión sináptica excitatoria, ya que cuando se producen este tipo de sinapsis, se libera el neurotransmisor glutamato, el cual es rápidamente removido del espacio extracelular por un sistema de captura mediado por transportadores, para que la transmisión del impulso nervioso pueda finalizar. Son los astrocitos los que captan el glutamato junto con iones Na+ (proporción 1:3), pero al mismo tiempo entra al astrocito 1 molécula de glucosa, que se utiliza para realizar glucólisis, obteniendo 2 ATP y liberándose 2 moléculas de lactato que son captadas y consumidas por las neuronas para producir 18 ATP por fosforilación oxidativa.
Desarrollo del metabolismo de los cuerpos cetónicos.
Durante la última etapa de la gestación, el feto acumula glucógeno en el cerebro en forma considerable, el cual puede hacer frente al requerimiento urgente de energía que se produce durante el nacimiento. Sin embargo, el glucógeno cerebral se consume rápidamente en las dos primeras horas de vida extrauterina. En la primera hora de vida extrauterina (en ratas) y en la primera media hora (humanos) no hay glucosa en la sangre. Dado que la gluconeogénesis no es plenamente activa hasta las 12 horas de vida la normoglucemia no se alcanza sino entre el 3-4to día de vida. En estas circunstancias, los requerimientos energéticos del cerebro son suplidos por los cuerpos cetónicos sintetizados por el propio feto a partir de los lípidos provenientes de la leche.
Es conocida la contribución de los cuerpos cetónicos plasmáticos al metabolismo energético del cerebro del neonato, así como su incorporación a los lípidos cerebrales y aminoácidos. Tanto en la rata como en el hombre, la concentración sanguínea de cuerpos cetónicos es muy baja en el momento del nacimiento (alrededor de 0.2 mM), pero experimenta un fuerte aumento a partir de las primeras horas de vida, alcanzando valores de aproximadamente 1-2 mM, a lo largo de la lactancia. El desarrollo de la vía cetogénica en el hígado neonatal junto con el aumento de la disponibilidad de sustratos para la misma, son responsables de la alta concentración plasmática de cuerpos cetónicos observados durante la lactancia. En estas circunstancias la concentración de 3-hidroxibutirato es superior (en 4 veces) a la del acetoacetato. Además, en condiciones de malnutrición neonatal prolongada, dichos valores aumentan en plasma y constituyen el soporte principal del metabolismo oxidativo cerebral.
El cerebro humano ya es capaz de metabolizar 3-hidroxibutirato entre las 12-21 semanas de gestación. Así, a las 22 semanas de gestación, ya están presentes la 3-hidroxibutirato deshidrogenasa, la 3-cetoácido-CoA transferasa y la acetoacetil-CoA tiolasa. Durante el desarrollo postnatal en cerebro humano, los cuerpos cetónicos cubren un 10% de las necesidades energéticas, aunque dicha contribución disminuye más adelante, a medida que se consolida la BHE. Se piensa que los ácidos grasos de cadena media son los principales precursores de los cuerpos cetónicos en estas circunstancias.
Aproximadamente, un 15% de estos ácidos grasos se utilizarían para la síntesis de cuerpos cetónicos en el hígado, mientras que el resto se oxidaría en los tejidos periféricos.
En la rata, la actividad de las enzimas encargadas de metabolizar los cuerpos cetónicos, aunque bajas, están ya presentes en el cerebro fetal. El acetoacetato se metaboliza más rápidamente que el 3-hidroxibutirato, indicando que la actividad de la 3-hidroxibutirato deshidrogenasa sería limitante. Posteriormente, aumentan todas las enzimas de la vía, alcanzando un valor máximo de actividad en el día 20 de vida postnatal, para disminuir hasta los niveles del adulto. Dichos cambios son paralelos a la capacidad de los sistemas de transporte de dichas sustancias. Se ha demostrado, que las células aisladas de cerebro de neonato de rata oxidan 3-hidroxibutirato de forma dependiente a su concentración, aproximándose a la saturación a las máximas concentraciones de cuerpos cetónicos circulantes durante la lactancia (2 mM), con una constante de afinidad (Km) similar a la del transportador de la membrana plasmática.
La regulación hormonal de las enzimas de utilización de cuerpos cetónicos parece estar a cargo, en parte, de las hormonas tiroideas. Por otra parte, la actividad de la enzima acetoacetil-CoA sintetasa, de localización citosólica, es más alta en el neonato de rata que en el adulto, hecho que sugiere que la síntesis de lípidos a partir de acetoacetato puede ocurrir directamente en el citosol.
Una vez dentro de la célula cerebral, los cuerpos cetónicos tienen dos destinos fundamentales: la oxidación y la síntesis de ácidos grasos y colesterol, y secundariamente, pueden ser precursores de acetilcolina y de aminoácidos. En condiciones normales, el 3-hidroxibutirato y la glucosa no son metabolizados en la misma proporción en todas las zonas del cerebro.
Las actividades de las enzimas implicadas en el metabolismo de los cuerpos cetónicos están presentes tanto en neuronas, como en astrocitos y en oligodendroglia. Sorprendentemente, los astrocitos muestran las actividades máximas de 3-oxoácido-CoA transferasa y la acetoacetil-CoA tiolasa durante el desarrollo. La utilización de cultivos primarios ha puesto de manifiesto que los cuerpos cetónicos pueden metabolizarse tanto en neuronas, como en astrocitos y en oligodendrocitos, donde sirven de fuente de energía y esqueletos carbonados. De todas maneras, la síntesis de colesterol en oligodendrocitos es mayor que en astrocitos, siendo el acetoacetato mejor precursor que la glucosa, tanto para la síntesis de colesterol como para la de ácidos grasos. Asimismo, los oligodendrocitos y las neuronas oxidan más rápidamente cuerpos cetónicos que los astrocitos. Por último, la síntesis de lípidos a partir de acetoacetato es ligeramente mayor en neuronas que en astrocitos, prefiriéndose al acetoacetato sobre la glucosa. Parece, por lo tanto que la utilización de cuerpos cetónicos es menor en astrocitos que en neuronas u otras células gliales.
Las enzimas encargadas del metabolismo de los cuerpos cetónicos se hallan presentes en todas las poblaciones celulares estudiadas, no obstante, se ha descripto que la actividad de la acetoacetil-CoA sintetasa es mayor en oligodendrocitos, lo que indica un papel predominante de dichas células en la síntesis de lípidos y, especialmente, de colesterol.
ConclusionesEstudios in vitro e in vivo indican que la estimulación fisiológica de una región dada del cerebro, gatilla una activación rápida de la glucogenólisis (exclusivamente astrocitaria), y de la glucólisis, lo cual a su vez resulta en la liberación de lactato.
Indudablemente muchas preguntas permanecen a la espera de respuestas que vendrán de la mano de futuras investigaciones. Por ejemplo: ¿cuáles son los mecanismos moleculares de acoplamiento entre la activación neuronal y la glucólisis astrocitaria? ¿Cuál es el rol de otros sustratos metabólicos, como citrato, a-cetoglutarato o malato, que se ha demostrado que son liberados desde los astrocitos hacia las neuronas? La glucólisis y la fosforilación oxidativa no están estrictamente compartimentados entre los astrocitos y las neuronas, respectivamente. Claramente algo de oxidación de glucosa ocurre en los astrocitos, y una liberación moderada de lactato puede ser demostrada en neuronas en cultivo; los mecanismos que regulan la actividad relativa de estos dos caminos metabólicos en neuronas y astrocitos aún necesitan ser dilucidados.
Bibliografía
Benington JH, Heller HC. Restoration of brain energy metabolism as the function of sleep. Prog Neurobiol. 1995 Mar;45(4):347-60. Review.
Bittar PG et al. Selective distribution of lactate dehydrogenase isoenzymes in neurons and astrocytes of human brain. J Cereb Blood Flow Metab 1996;16(6):1079-89.
Chatton JY et al. A quantitative analysis of L-glutamate-regulated Na+ dynamics in mouse cortical astrocytes: implications for cellular bioenergetics. Eur J Neurosci 2000;12(11):3843-53.
Debernardi R et al. Trans-inhibition of glutamate transport prevents excitatory amino acid-induced glycolysis in astrocytes. Brain Res 1999;850(1-2):39-46.
Dalsgaard MK et al. Cerebral metabolism is influenced by muscle ischaemia during exercise in humans. Exp Physiol 2003;88(Pt 2):297-302.
"Fundamental Neuroscience". Editado por M. Zigmond y col. Academic Press, 1999.
Magistretti PJ, Pellerin L Astrocytes couple synaptic activity to glucose utilization in the brain. News Physiol Sci 1999;14:177-182.
Magistretti PJ. Cellular bases of functional brain imaging: insights from neuron-glia metabolic coupling. Brain Res 2000;886(1-2):108-112.
Magistretti PJ, Pellerin L. Regulation by neurotransmitters of glial energy metabolism. Adv Exp Med Biol 1997;429:137-43.
Pellerin L et al. Evidence supporting the existence of an activity-dependent astrocyte-neuron lactate shuttle. Dev Neurosci 1998;20(4-5):291-9.
Petit JM et al. Sleep deprivation modulates brain mRNAs encoding genes of glycogen metabolism. Eur J Neurosci 2002;16(6):1163-7.
Pierre K et al. Cell-specific localization of monocarboxylate transporters, MCT1 and MCT2, in the adult mouse brain revealed by double immunohistochemical labeling and confocal microscopy. Neuroscience 2000;100(3):617-27.
Shulman RG et al. Lactate efflux and the neuroenergetic basis of brain function. NMR Biomed. 2001 Nov-Dec;14(7-8):389-96.
Voutsinos-Porche B et al. Glial glutamate transporters mediate a functional metabolic crosstalk between neurons and astrocytes in the mouse developing cortex. Neuron. 2003;37(2):275-86
| |
|
|---|---|
|
revista digital
· Año 9 · N° 62 | Buenos Aires, Julio 2003
| |